Unser Diagnostik-Portfolio für Tumorerkrankungen
Was ist eine genetische Tumordiagnostik?
Krebs entsteht als Folge eines abweichenden Zellverhaltens bezüglich Zellwachstum und Zellsterben basierend auf Veränderungen im Erbgut der Tumorzellen. Daher ist die genetische Tumordiagnostik ein wirkungsvolles Diagnoseinstrument zum Erkennen dieser genetischen Veränderungen, die nachfolgend eine Therapierelevanz haben können.
Eine umfangreiche Diagnostik ist die Grundvoraussetzung für das Verständnis der Erkrankung. Fragen wie „woher kommt der Tumor“ in Bezug auf eine Erblichkeit werden ebenso adressiert wie die Frage nach einer effizienten Therapiestrategie.
Auf der Grundlage der gewonnenen Informationen können Ärztinnen und Ärzte, Patientinnen und Patienten sowie deren Familienangehörige umfangreich betreuen.
Die genetische Diagnostik sollte frühzeitig integriert werden, denn umfassendes Wissen über die Erkrankung ist ein wesentlicher Schritt in der individualisierten Betreuung und Behandlung der Patientin, bzw. des Patienten.
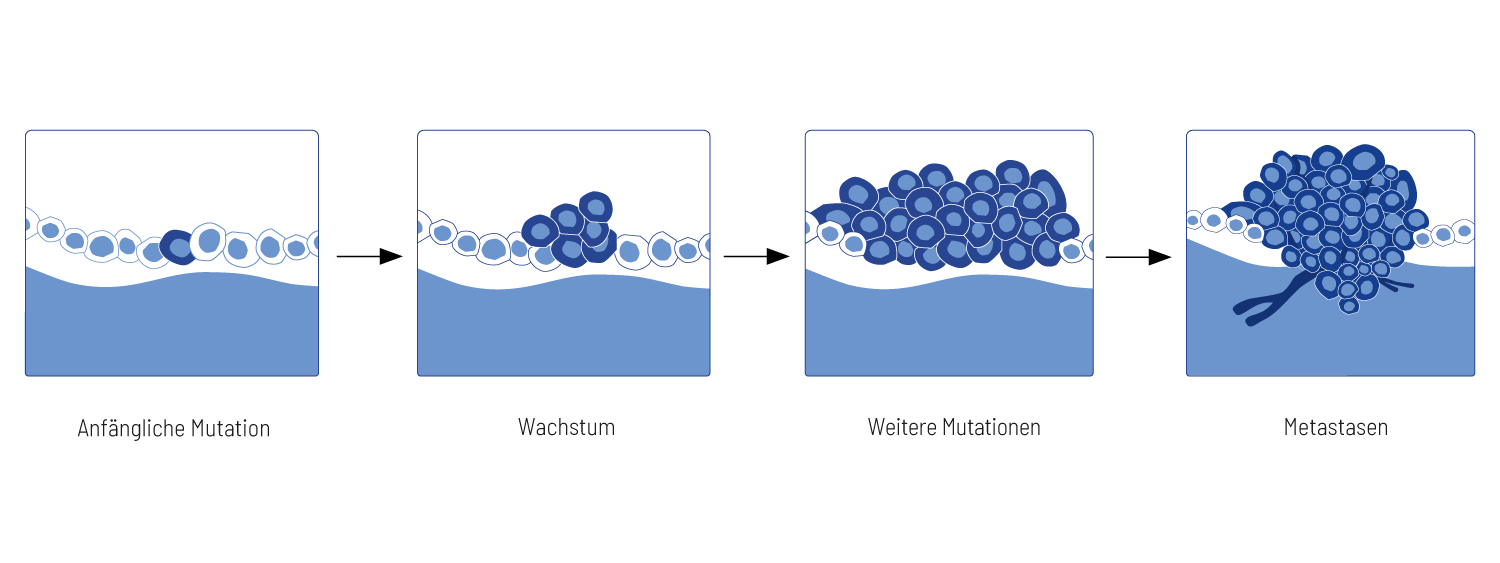
Tumorentwicklung
Tumoren entstehen durch unerwünschte Veränderungen in den Genen. Diese sogenannten Mutationen geschehen meist zufällig und werden typischerweise durch die DNA-Reparatursysteme der Zelle korrigiert. Die Exposition gegenüber Karzinogenen, wie Tabakrauch oder UV-Strahlung, erhöht die Zahl der Mutationen. Diese erworbenen Mutationen werden als somatische Mutationen bezeichnet. Eine nicht korrekt reparierte Mutation kann zu Krebs führen. Krebsfördernde somatische Mutationen verursachen veränderte Proteinfunktionen, die in dysregulierten zellulären Prozessen resultieren. Zunächst fördern diese genetischen Veränderungen den Verlust der Wachstumskontrolle in den betroffenen Zellen während der Zellteilung. Weitere Mutationen führen zur Selektion von Zellklonen, die die Proliferation erfolgreich fortsetzen und ihre Sterblichkeitsrate senken. Im Verlauf der Tumorprogression häufen sich weitere Mutationen an und fördern die Streuung der Tumorzellen auf entfernte Organe (Metastasierung). Die somatischen Mutationen, die von Tumoren im Verlauf der Erkrankung erworben werden, sind individuell und unterscheiden sich nicht nur zwischen verschiedenen Tumorentitäten, sondern auch zwischen einzelnen Tumorerkrankten. Krebs ist also eine multifaktorielle und heterogene genetische Erkrankung.
NGS-basierte Onkogenetik — eine neue Ära der Tumorcharakterisierung
Die individuellen tumorspezifischen Mutationen helfen dem Tumor zu überleben und eine Resistenz gegen therapeutische Wirkstoffe zu entwickeln. Um eine vielversprechende Behandlungsstrategie zu wählen, ist ein tiefer und genauer Einblick in die molekularen Grundlagen der einzelnen Tumoren erforderlich. Der Einsatz der sogenannten Next-Generation Sequencing (NGS)-Technologie hat eine neue Ära in der Krebstherapie eingeleitet und bildet die Basis der personalisierten Präzisionsmedizin. Durch die NGS-Analyse können die onkologischen Behandlungen auf die genetischen Merkmale jeder Patientin und jedes Patienten sowie auf die Veränderungen des Tumors abgestimmt werden. Hiermit werden die Heilungschancen maximiert und die Schädigung des gesunden Gewebes minimiert.1, 2, 3
Die genetische Tumordiagnostik ist die Grundlage für die beste Therapiestrategie
Die genetische Analyse des Tumors ist für die Wahl der optimalen Behandlung von entscheidender Bedeutung. Je nach Art der zur Verfügung stehenden Tumorprobe sind unterschiedliche Untersuchungen möglich. Die folgende Tabelle vergleicht verschiedene molekulargenetische Untersuchungen auf Grundlage der jeweiligen Probenart.
Vollständige molekulargenetische Analyse | Identifikation von Neoantigenen | Gezielte Analyse | Hotspot-Analyse / Monitoring | |
Probenart | Solides Tumorgewebe / | Solides Tumorgewebe | Solides Tumorgewebe | Liquid Biopsy |
Leistungsumfang | > 700 Gene und Fusionen | Vollständige Exom- | Krankheitsspezifische Gen-Sets mit insgesamt | Hot-Spot-Regionen in 31 Genen sowie Fusionen in 6 Genen (TP53 gesamte kodierende Region) |
Vergleich mit normalem Gewebe | ✓ | ✓ | ✗ | ✗ |
Detaillierte Auflistung von Medikamentenoptionen | ✓ | ✓ | ✓ | ✓ |
Detektionsschwelle (Novel allele frequency, NAF) | 5 % | 5 % | 5 % | 0,25 % |
Minimaler Tumorgehalt | 20 % | 20 % | 20 % | 1 % |
SNV & INDELS | ✓ | ✓ | ✓ | ✓ |
CNV | ✓ | ✓ | ✗ | ✗ |
TMB | ✓ | ✓ | ✗ | ✗ |
MSI | ✓ | ✓ | ✓ (zusätzlicher Auftrag) | ✗ |
HRD | ✓ | ✓ | ✗ | ✗ |
Fusionsgenanalyse / strukturelle Varianten (DNA-basiert) | ✓ | ✓ | ✓ | ✗ |
Zusatzoption: RNA-basierte Fusionstranskriptanalyse (CancerFusionRx®) | ✓ (nur mit FFPE) | ✓ | ✓ | ✗ |
HPV/EBV Infektion | ✓ | ✗ | ✗ | ✗ |
HLA-Typisierung | ✓ | ✓ | ✗ | ✗ |
Neoantigen | ✗ | ✓ | ✗ | ✗ |
Pharmakogenetische Varianten (Auswahl) | ✓ | ✓ | ✗ | ✗ |
CHIP-Detektion | ✓ | ✓ | ✗ | ✗ |
Darstellung von biologischen Signalwegen und des Coverage-Profils (Kopienzahlveränderungen) | ✓ | ✓ | ✗ | ✗ |
Leistungsfähige Liquid-Biopsy-Analysen
Tumorprofiling durch einfache Blutprobe
Die Liquid-Biopsy-Analyse ist ein optimales alternatives Testverfahren in Fällen, in denen kein Tumorgewebe verfügbar ist, z. B. bei inoperablen Tumoren oder einem schlechten Patientenzustand. Die Grundlage der Liquid-Biopsy-Analyse ist zellfreie DNA (cfDNA), die von nekrotischen und apoptotischen Zellen in die Blutbahn abgegeben wird. Die zirkulierende cfDNA wird sowohl von normalen als auch von Tumorzellen freigesetzt. Der Anteil der vom Tumor stammenden cfDNA (zirkulierende Tumor-DNA/ctDNA) hängt von der Tumorentität, dem Stadium der Erkrankung, der Tumorlast und weiteren Faktoren ab und ist daher nicht bei jeder Patientin und jedem Patienten gleich. Da nur ein Bruchteil der zirkulierenden cfDNA aus dem Tumor stammt, sind hochsensitive Methoden erforderlich, um minimale ctDNA-Konzentrationen nachzuweisen. CeGaT hat umfangreiche Liquid-Biopsy-Panels, die zellfreie DNA untersuchen, entwickelt und validiert.
CancerPrecision® nutzt Liquid-Biopsy-Analysen, um ein vollständiges genetisches Profil des Tumors zu erstellen und damit die behandelnde Ärztin sowie den behandelnden Arzt bei der Wahl der Therapie zu unterstützen. Für diese Analyse ist ein Tumoranteil von mindestens 20 % erforderlich. Da der Anteil an ctDNA unter 20 % liegen kann, bietet CeGaT zudem ein duplex UMI*-basiertes Panel an. CancerDetect® weist Sequenzvarianten in den handlungsrelevanten, am häufigsten vorkommenden Treibermutationen mit einer Allelfrequenz über 0,25 % nach. Dieser hochsensitive Nachweis tumorspezifischer Biomarker stellt ein hervorragendes Werkzeug zum Monitoring des Therapieansprechens und der minimalen Resterkrankung dar. Aufgrund der hohen Sensitivität des Ansatzes ist ein falsch negativer Befund aufgrund eines geringen Tumorgehalts der Probe weitaus unwahrscheinlicher.
*Unique molecular identifier
Vorteile von Liquid-Biopsy-Analysen
- Nicht-invasiv
- Schnelle und präzise Diagnose
- Echtzeitüberwachung von Therapien
- Frühzeitige Erkennung von Wiederauftreten (Rezidiv) oder Fortschreiten der Erkrankung
Integration von genetischem Tumor-Profiling in das Patientenmanagement
Unsere somatischen Tumor-Analysen begleiten optimal — von der Diagnose bis zum Monitoring
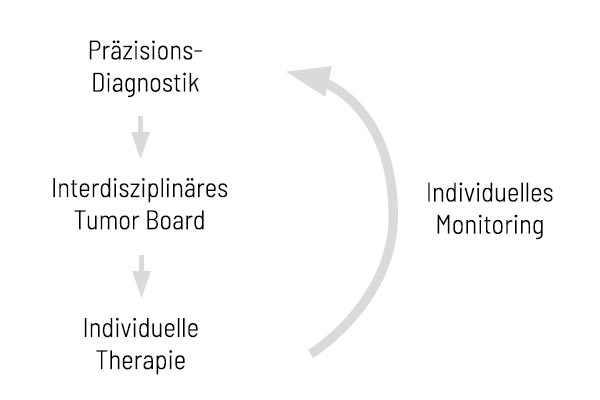
Zeit ist bei der Behandlung von Krebspatientinnen und Krebspatienten kostbar. Je früher Krebs erkannt wird und je früher eine wirksame Behandlung erfolgt, desto höher ist die Chance auf Heilung. Wenn man die molekularen Details des Tumors frühzeitig erkennt, ermöglicht dies eine wirksame Behandlung in einem frühen Stadium. Die beste Strategie ist ein detaillierter diagnostischer Ansatz, der auch unsere CancerPrecision®-Analyse beinhaltet, um die genetischen Veränderungen des Tumors zu untersuchen.
Anschließend sollten die Ergebnisse in einem lokalen interdisziplinären MTB diskutiert werden. Auf der Grundlage aller verfügbaren Informationen über den Tumor und die Patientin, bzw. den Patienten, entscheidet dieses Gremium über die vielversprechendste Behandlungsstrategie. Diese individualisierte Therapie sollte angewendet und die Patientin, bzw. der Patient, während der Behandlung auf Erfolg überwacht werden. Je nach Einzelfall sollte das Monitoring auch genetische Marker enthalten, wie unsere CancerDetect® Analyse, um Resistenzmechanismen oder Rezidive frühzeitig zu erkennen.
Referenzen
1 Walter, C. et al. Sequencing for an interdisciplinary molecular tumor board in patients with advanced breast cancer: experiences from a case series. Oncotarget 11, 3279–3285; 10.18632/oncotarget.27704 (2020).
2 Morganti, S. et al. Role of Next-Generation Sequencing Technologies in Personalized Medicine. In P5 eHealth: An Agenda for the Health Technologies of the Future, edited by G. Pravettoni & S. Triberti (Springer International Publishing, Cham, 2020), 125–154; 10.1007/978-3-030-27994-3_8 (2020).
3 Wu, T.-M. et al. Power and Promise of Next-Generation Sequencing in Liquid Biopsies and Cancer Control. Cancer control : journal of the Moffitt Cancer Center 27, 1073274820934805; 10.1177/1073274820934805 (2020).
Unsere Akkreditierungen
Verbindliche Standards gewährleisten die Qualität unserer Arbeit: Unsere Laborleistung ist nach CAP/CLIA und DIN EN ISO 15189 akkreditiert. Weitere Akkreditierung und Zertifizierungen finden Sie hier.
Schauen Sie sich auch gerne folgende Bereiche an
Kontaktieren Sie uns
Sie haben noch eine Frage oder Interesse an unserem Service?
Diagnostik-Support
Wir unterstützen Sie auf Wunsch bei der Auswahl der diagnostischen Strategie – für jede einzelne Patientin und jeden einzelnen Patienten.